Di-ethylzink
| Di-ethylzink | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
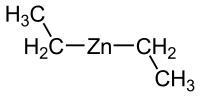 | |||||
Structuurformule van di=ethylzink | |||||
 | |||||
"Ball and stick"model van di-ethylzink | |||||
| Algemeen | |||||
| Molecuulformule | |||||
| IUPAC-naam | di-ethylzink | ||||
| Molmassa | 123,50 g/mol | ||||
| SMILES | CC[Zn]CC | ||||
| CAS-nummer | 557-20-0 | ||||
| PubChem | 11185 | ||||
| Wikidata | Q420423 | ||||
| Beschrijving | Kleurloze vloeistof | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H225 - H250 - H260 - H302+H312+H332 - H314 - H410 | ||||
| P-zinnen | P210 - P222 - P223 - P231+P232 - P233 - P240 - P241 - P242 - P243 - P260 - P264 - P273 - P280 - P301+P330+P331 - P302+P334 - P303+P361+P353 - P304+P340 - P305+P351+P338 - P310 - P321 - P335+P334 - P363 - P370+P378 - P391 - P402+P404 - P403+P235 - P405 - P422 - P501[2] | ||||
| EG-Index-nummer | 209-161-3 | ||||
| VN-nummer | 1366 | ||||
| Fysische eigenschappen | |||||
| Dichtheid | 1,205 g/cm³ | ||||
| Smeltpunt | -28 °C | ||||
| Kookpunt | 117 °C | ||||
| Oplosbaarheid in water | reageert g/L | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Di-ethylzink, , vaak afgekort tot DEZ, is een zeer pyrofore en reactieve stof, bestaande uit een zink-atoom waaraan 2 ethylgroepen gekoppeld zijn. Deze kleurloze vloeistof is een veel gebruikt reagens in de organische chemie. De stof is commercieel verkrijgbaar als zuivere stof of als oplossing in hexaan, heptaan of tolueen.
Synthese
Edward Frankland was de eerste die in 1848 de synthese van di-ethylzink beschreef als product van de reactie tussen joodethaan en zink.[3][4] 16 jaar later publiceerde hij een verbeterde methode met di-ethylkwik als uitgangsstof.[5] De huidige methode bestaat uit de reactie van een 1:1 mengsel van joodethaan en broomethaan dat met zink-koper-koppel (een bron van geactiveerd zink) reageert tot DEZ.
Externe link
- Demonstratie van de reactie van di-ethylzink in lucht: Video - University of Nottingham
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Diethylzinc op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ MSDS
- ↑ New Environment Inc. - NFPA Chemicals.
- ↑ E. Frankland (1850). On the isolation of the organic radicals. Quarterly Journal of the Chemical Society 2 (3): 263–296. DOI: 10.1039/QJ8500200263.
- ↑ Dietmar Seyferth (2001). Zinc Alkyls, Edward Frankland, and the Beginnings of Main-Group Organometallic Chemistry. Organometallics 20 (14): 2940–2955. DOI: 10.1021/om010439f.
- ↑ E. Frankland, B. F. Duppa (1864). On a new reaction for the production of the zinc-compounds of the alkyl-radical. Journal of the Chemical Society 17: 29–36. DOI: 10.1039/JS8641700029.
















