Codeína
| Codeína | ||
|---|---|---|
 | ||
 | ||
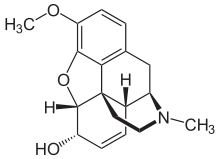
| Nombre (IUPAC) sistemático | ||
| (5α,6α)-7,8-didehidro-4,5-epoxi- 3-metoxi-17-metilmorfinan-6-ol | ||
| Identificadores | ||
| Número CAS | 76-57-3 | |
| Código ATC | R05DA04 | |
| PubChem | 5284371 | |
| DrugBank | DB00318 | |
| ChemSpider | 4447447 | |
| UNII | UX6OWY2V7J | |
| KEGG | C06174 | |
| ChEBI | 16714 | |
| ChEMBL | ChEMBL485 | |
| Datos químicos | ||
| Fórmula | C18H21NO3 | |
| Farmacocinética | ||
| Biodisponibilidad | ~90 % oral | |
| Datos clínicos | ||
| Estado legal | Grupo I ℞-Receta especial requerida (MEX) Grupo I ℞-Receta especial requerida (MEX), Grupo 2 opioide no sometido a control especial (COL) | |
| Vías de adm. | Oral Parenteral | |
[editar datos en Wikidata] | ||
La codeína es un fármaco opiáceo que se prescribe en el tratamiento del dolor (analgésico) y la tos (antitusígeno). Se encuentra naturalmente en la savia de la adormidera o amapola, (Papaver somniferum).
Se metaboliza en morfina en el hígado, pero debido a la baja velocidad de transformación, es mucho menos efectiva como analgésico y sedante que la morfina. Por lo anterior, se puede obtener un mayor beneficio cuando se combina con paracetamol (acetaminofeno) o un medicamento antiinflamatorio no esteroideo (AINE), como aspirina o ibuprofeno. La evidencia no respalda su uso para la supresión de la tos aguda en niños. En Europa, no se recomienda como medicamento para la tos en menores de 12 años.
Se toma por vía oral en forma de comprimidos o jarabe. Por lo general, comienza a actuar después de media hora, con un efecto máximo a las dos horas. Sus efectos duran entre cuatro y seis horas. La codeína presenta un potencial de abuso similar al de otros medicamentos opioides, incluido el riesgo de habituación y sobredosis.
Los efectos secundarios comunes incluyen vómitos, estreñimiento, picazón, aturdimiento y somnolencia. Los efectos secundarios graves pueden incluir dificultades respiratorias y adicción. No está claro si su uso durante el embarazo es seguro. Se debe tener cuidado durante la lactancia, ya que puede provocar toxicidad por opiáceos en el bebé. Su uso a partir de 2016 no se recomienda en niños.
Historia
La codeína es un alcaloide que se encuentra en la amapola, Papaver somniferum esta se ha cultivado y utilizado a lo largo de la historia de la humanidad por sus propiedades medicinales (analgésicas y antitusivas) e hipnóticas relacionadas con la diversidad de sus componentes activos, que incluyen morfina, codeína y papaverina.
El nombre codeína se deriva del griego antiguo κώδεια (kṓdeia , "cabeza de amapola"). La proporción relativa de codeína y morfina, el alcaloide del opio más común, entre el 4% y el 23%, tiende a ser algo mayor en el método de la paja de adormidera para preparar los alcaloides del opio.
Hasta principios del siglo XIX, el opio crudo se utilizaba en diversas preparaciones conocidas como láudano y en elixires paregóricos, algunos de los cuales fueron populares en Inglaterra desde el principio del siglo XVIII; la preparación original parece haber sido elaborada en Leiden, Países Bajos, alrededor de 1715 por el químico Jakob Le Mort. En 1721 la Farmacopea de Londres menciona un Elixir Asthmaticum, reemplazado por el término Elixir Paregoricum ("calmante del dolor") en 1746.

La morfina ya había sido aislada en Alemania por Friedrich Sertürner en 1804. Por el lado de la codeína, fue aislada por primera vez en 1832 en Francia por Pierre Robiquet, ya famoso por el descubrimiento de la alizarina, el colorante rojo más difundido, mientras trabajaba en los procesos de extracción refinada de la morfina. A Robiquet también se le atribuye el descubrimiento de la cafeína.
Para 1830, se incrementó el uso del opio con fines recreativos y la dependencia de la droga en Inglaterra alcanzó su punto más alto. En 1839, los británicos enviaron barcos de guerra a la costa de China, en respuesta al intento de esa nación de prohibir el tráfico de opio. Así se inició la “primera guerra del opio”.
En 1874, varios químicos desarrollaron la heroína, en un intento por encontrar una forma menos adictiva de la morfina. Pero la heroína era el doble de adictiva que la morfina, y la adicción a esta se convirtió en un grave problema.
Thomas Anderson determinó la composición correcta en 1853, pero John Masson Gulland y Robert Robinson propusieron una estructura química como tal, recién en 1925. Por otro lado, la codeína y la morfina, así como el opio, se utilizaron en un intento de tratar la diabetes en la década de 1880 y posteriormente, en fechas tan recientes como la de 1950. La primera estructura cristalina tendría que esperar hasta 1954.
El opio en polvo contiene una cantidad de alcaloides, de los cuales sólo unos pocos (morfina, codeína y papaverina) tienen utilidad clínica. Estos alcaloides del opio se dividen en dos clases químicas distintas, fenantrenos y bencilisoquinolinas. Los principales fenantrenos son morfina (10% de opio), codeína (0.5%) y tebaína (0.2%). Las principales bencilisoquinolinas son la papaverina (1%) (un relajante muscular liso) y la noscapina (6%).
Farmacocinética
Vías de administración
Se administra por vía oral, vía parenteral y vía rectal. ↿
Absorción
La codeína y sus sales se absorben en el tracto gastrointestinal, el inicio de su efecto es alrededor de 30 minutos, alcanzando concentraciones plasmáticas máximas aproximadamente 1 hora posterior a su administración, que persisten entre 3 y 4 horas después de una dosis oral o intramuscular. ↿ Su biodisponibilidad es del 90%. 3
Distribución
Se distribuye ampliamente con preferencia hacia los órganos parenquimatosos como el hígado, bazo y riñón. Con un volumen de distribución de 3-6 L/kg. Tiene una baja unión a las proteínas plasmáticas (7-25%) y no se acumula en los tejidos corporales. La codeína atraviesa la barrera hematoencefálica y se encuentra en los tejidos fetales y en la leche materna. 2 3
Metabolismo y metabolitos
Se metaboliza en el hígado, mediante conjugación con ácido glucurónico a codeína-6 glucurónido (C6G), por O-desmetilación a morfina (aproximadamente 5-10%) y N-desmetilación a norcodeína ( alrededor del 10%) respectivamente. La UDP-glucuronosiltransferasa (UGT) 2B7 y 2B4 son las principales enzimas metabólicas que median la glucurodinación de la codeína al metabolito C6G.
El citocromo P450 2D6 es la principal enzima responsable de la transformación de codeína en morfina y la P450 3A4 es la principal enzima que media en la conversión de codeína en norcodeína. Luego, la morfina y la norcodeína se metabolizan aún más mediante conjugación con ácido glucurónico. Los metabolitos glucurónidos de la morfina son morfina-3-glucurónido (M3G) y morfina-6-glucurónido (M6G). 3
Diferencia estructural entre Codeína y Morfina

La principal diferencia estructural entre la codeína y la morfina es la presencia de un grupo metoxilo (-OCH₃, círculo rojo) en la codeína en lugar del grupo hidroxilo (-OH, círculo azul) que se encuentra en la morfina en el carbono 3. Esta diferencia afecta la forma en que el cuerpo metaboliza cada compuesto. Además, se ve en imagen la enzima encargada de convertir la codeína en morfina, CYP2D6, mediante una O-desmetilación. 3
Excreción
La codeína se excreta en un 90% por los riñones, y su semivida de eliminación es de aproximadamente 3-4 horas. Los productos excretados por la orina consisten en codeína libre y en su derivado glucurónido-conjugado (alrededor del 70%), norcodeína libre y conjugada (alrededor del 10%), morfina 8 de 9 libre y conjugada (alrededor del 10%), normorfina (4%) e hidrocodona (1%). El resto de la dosis se excreta por las heces. ²
Farmacodinámica
La codeína funciona principalmente como un analgésico y antitusivo a través de su conversión a morfina y la activación de receptores opioides, con variaciones en la respuesta terapéutica debido a diferencias genéticas en el metabolismo.

Mecanismo de Acción
La codeína es un opioide que se convierte en morfina en el cuerpo, principalmente a través de la acción de la enzima CYP2D6. Actúa como un agonista parcial de los receptores mu-opioides (μ), κ (kappa) y δ (delta) en el sistema nervioso central. La unión a estos receptores inhibe la transmisión de señales de dolor y modifica la percepción del dolor.
Mecanismos indirectos
Los opioides, dependiendo de la dosis, reducen la liberación de acetilcolina en varias áreas del cerebro, incluidos el hipocampo, cuerpo estriado y la corteza cerebral. El mecanismo tiene que ver con la entrada de Ca2 +, y no con mecanismos GABAérgicos.
Por otro lado, la liberación central de monoaminas está influenciada por los opioides. De hecho, se sabe que los mecanismos analgésicos de los opioides dependen de proyecciones descendentes de monoaminas. Los agonistas opioides de los receptores μ, κ y δ inhiben la liberación de norepinefrina en el hipotálamo y corteza. Este efecto está mediado por receptores μ ubicados en neuronas noradrenérgicas. Las proyecciones corticales de serotonina, por el contrario, no se ven afectadas por los opioides.
En general, los agonistas μ aumentan la transmisión en el sistema mesolímbico dopaminérgico. Inhiben las neuronas GABAérgicas en el área tegmental ventral, desinhibiendo la actividad de la dopamina. Por el contrario, los agonistas κ inhiben la liberación de dopamina en el mismo sistema. Al igual que con otras drogas de abuso, se cree que una influencia sobre la dopamina mesolímbica media los efectos de refuerzo de los opioides.
Efectos farmacológicos
- Analgesia: La principal aplicación de la codeína es como analgésico para el alivio del dolor leve a moderado. Además de reducir el aspecto sensorial del dolor, los opioides pueden alterar el aspecto emocional, donde el dolor está presente, pero no causa tanto problema. Sin embargo, incluso la morfina intratecal sola reduce el dolor, por lo que los cambios emocionales no son los únicos responsables.
- En general, el dolor continuo y sordo responde mejor a los opioides que el dolor agudo e intermitente, pero dosis suficientes pueden reducir ambos tipos. Aunque el dolor por daño tisular responde a los opioides, el dolor debido a una lesión nerviosa (dolor neuropático) no.
- Antitusivo: La codeína también se usa como supresor de la tos debido a su efecto depresor en el centro de la tos en el cerebro. Irónicamente, la heroína se desarrolló como medicamento para la tos con la esperanza de que tuviera efectos menos tóxicos y adictivos.
- Efectos en el sistema gastrointestinal: Los agonistas del sistema digestivo disminuyen la secreción de ácido del estómago, reducen la motilidad gástrica y prolongan el vaciado gástrico. Se reducen las secreciones pancreáticas, biliares e intestinales. Los movimientos peristálticos se reducen, pero el tono aumenta, lo que a veces provoca espasmos.
- Los opioides también aumentan la presión de los conductos biliares. La codeína también provoca náuseas y vómitos por estimulación del área postrema.
- Efectos en el sistema cardiovascular: La codeína no tiene efectos cardiovasculares significativos si la persona está en decúbito supino, pero puede producirse hipotensión ortostática debido a la vasodilatación periférica y la inhibición de los reflejos barorreceptores. Los efectos miocárdicos no son significativos en individuos normales, pero pueden ser más variables durante el infarto de miocardio.
- Miosis: La codeína causa constricción de la pupila por una acción directa sobre el nervio parasimpático. La miosis es patognomónica de la sobredosis de opioides (específicamente agonistas μ), pero la midriasis ocurre con supresión respiratoria y asfixia.
- Efectos en el sistema respiratorio: Los ligandos respiratorios μ y δ participan en la regulación de la respiración. La supresión respiratoria es una característica habitual de la codeína, que suprime todas las fases de la respiración. El paro respiratorio no es una causa de muerte común en la población general, pero sí se restringe su uso en niños menores a 2 años porque en esa población hay probabilidad de muerte. Sin embargo, en dosis terapéuticas normales, los efectos respiratorios no son problemáticos en personas sin enfermedad pulmonar. La depresión respiratoria resulta de la alteración de la respuesta de las áreas del tronco del encéfalo a los niveles de dióxido de carbono.
- Efectos neuroendocrinos: A través de acciones hipotalámicas, la codeína inhibe la liberación de la hormona liberadora de gonadotropina y de la hormona liberadora de corticotropina. En consecuencia, hay una disminución de los niveles circulantes de la hormona luteinizante, la hormona folículo estimulante, la hormona adrenocorticotrópica, la b-endorfina, la testosterona y el cortisol. Se producen niveles elevados de prolactina, posiblemente a través de interacciones con sistemas dopaminérgicos. Sin embargo, con la administración crónica se desarrolla tolerancia a estos efectos neuroendocrinos, y estos no se presentan tan frecuentemente.
- Efectos sobre el comportamiento: Los opioides producen sedación, pero no tan profundamente como los depresores del SNC como los barbitúricos o los anestésicos generales. Una persona a la que se le administra un opioide suele estar letárgica pero excitable.
- Dependencia y Adicción: aparecen cuando se administran de forma repetida, y se cree que es resultado de la desensibilización de los receptores opioides y alteraciones en la interacción entre las proteínas G y el adenilato ciclasa. El síndrome de abstinencia aparece ante una suspensión abrupta de opioides o el uso de antagonistas.
- Dentro de las 8 horas de la suspensión, la persona experimenta lagrimeo, bostezos, sudoración y secreción mucosa.
- A las 12 a 14 horas de la suspensión, la persona presenta sacudidas y sueño inquieto.
- El pico ocurre entre las 48 y 72 horas, con dilataciones de las pupilas, incapacidad para comer, piel de gallina, inquietud, taquicardia, temblores motores, calambres musculares, náuseas, diarrea, espasmos intestinales y escalofríos y sofocos alternos. Durante este tiempo, es comprensible que la persona esté irritable, ansiosa y disfórica.
- Dependencia y Adicción: aparecen cuando se administran de forma repetida, y se cree que es resultado de la desensibilización de los receptores opioides y alteraciones en la interacción entre las proteínas G y el adenilato ciclasa. El síndrome de abstinencia aparece ante una suspensión abrupta de opioides o el uso de antagonistas.
Indicaciones
Las indicaciones aprobadas para la codeína son:
- tos: es eficaz a bajas dosis.[1]
- diarrea
- dolor leve a severo
- síndrome del intestino irritable
Efectos secundarios
Efectos fisiológicos
- Reducción de la frecuencia cardíaca
- Reducción de la presión sanguínea
- Reducción de la temperatura corporal
- Contracción de la pupila
- Dependencia
- Estreñimiento
- Letargo
- Mareo (suave)
- Somnolencia (en algunas ocasiones)
Efectos psicológicos
- Adicción
- Alucinaciones
- Confusión mental
- Euforia
- Sensación de bienestar
Contraindicaciones

La codeína por ser un analgésico medio, derivado del opio puede generar dependencia al igual que la morfina, por lo tanto su consumo es solo con prescripción médica, esta sustancia actúa sobre el sistema nervioso y el cerebro provocando euforia, pero a dosis altas causan depresión respiratoria. Consumir opiáceos en combinación con otras sustancias depresoras del sistema nervioso central (SNC) como alcohol, antihistamínicos, ansiolíticos (tranquilizantes) o anestésicos puede causar problemas a la salud.[2]
Esta sustancia la mayoría de veces se encuentra en los jarabes para la tos, por eso en los últimos años esta sustancia se ha empleado con fin narcótico, la Purple Drank es una bebida que utiliza la codeína para producir efectos parecidos a los de un sedante.
Metabolismo
La codeína se metaboliza en el hígado, a través de reacciones de O-desmetilación, N-desmetilación y conjugación con glucurónico. Uno de sus metabolitos es la morfina, responsable de ciertos efectos de la codeína.
La codeína se elimina mediante metabolismo y su posterior excreción en la orina, en la que aparece como norcodeína, morfina y conjugados, fundamentalmente. Pequeñas cantidades de codeína y sus metabolitos se eliminan con las heces. Su semivida es de tres horas.
Referencias
- ↑ Schroeder K, Fahey T (2001). «Over-the-counter medications for acute cough in children and adults in ambulatory settings.». Cochrane Database Syst Rev: CD001831. doi:10.1002/14651858.CD001831. PMID 15495019.
- ↑ Benjamín Ruiz Loyola (abril de 2009). «Del abuso a la adicción». ¿Cómo ves?. UNAM. Consultado el 3 de diciembre de 2016.
Enlaces externos
- Codeína en Nomenclator
- En MedlinePlus hay más información sobre Codeína
 Datos: Q174723
Datos: Q174723 Multimedia: Codeine / Q174723
Multimedia: Codeine / Q174723










